ヒト病態循環シミュレータ班
大動脈弁再留置術時の冠動脈閉塞リスクの評価に向けた体循環及び冠循環模擬シミュレータの開発
左心室と大動脈の間にある大動脈弁の開閉が制限され全身に血液を送り出すことが出来なくなる状態を大動脈弁狭窄症と呼びます。この疾患の治療方法としてカテーテルを用いて弁の内側から人工弁(TAV)を留置する大動脈弁留置術(TAVI)が行われております。しかし近年そのTAVが経年劣化した患者が増加してきており,先行留置したTAVの内側にさらにTAVを留置する大動脈弁再留置術(TAV in TAV)が新たな治療法として注目を集めています。しかしTAV in TAVは先行留置したTAVの弁尖が開放した状態で固定されるため、体格の小さな患者、特に日本人の小さな大動脈弁では大動脈弁の側面から走行している冠動脈への血流が途絶える(冠動脈閉塞)リスクが報告されております。
本研究は、TAV in TAVが冠動脈血流に与える影響を生体外試験によって解明するために、体循環及び冠循環を模擬したシミュレータ(図1)を開発し、粒子画像流速計測法(PIV:Particle Image Velocimetry)を用いて大動脈弁及び冠動脈血流の可視化(図2)を行っています。

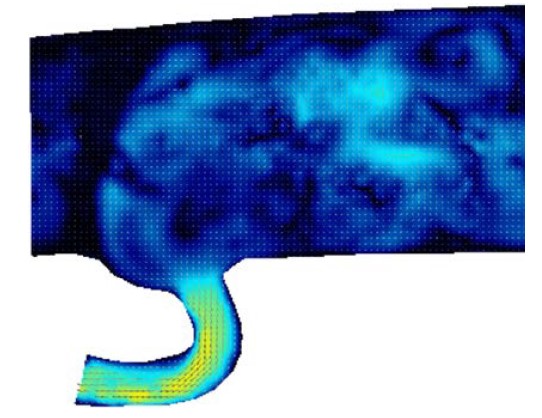
図1 体循環及び冠循環シミュレータ 図2 大動脈弁及び冠動脈血流の可視化
僧帽弁閉鎖不全症に対する治療法を評価する生体外評価試験システムの研究開発
僧帽弁は左心室と左心房の間にある弁であり、この弁が閉鎖不全により逆流する状態を僧帽弁閉鎖不全症と呼びます。僧帽弁閉鎖不全症に対する治療法には患者の自己弁を温存し治療する形成術が多く用いられています。僧帽弁閉鎖不全症が生じる要因は複数ありそれぞれに適した形成術が施行されますが、より良い治療法・治療デバイスを提供するには、病変状態を模擬した生体外評価試験システムを開発することが重要となります。
本研究ではブタ摘出僧帽弁の弁輪を分解させながら拡張した逆流症モデルを作製し、体循環模擬シミュレータ(図1)に取り付け、逆流症状態を模擬した生体外評価試験システムを開発しています。作製した逆流症モデルに形成術を施行することにより形成前後における血行動態・弁開閉挙動を評価し、新たな治療法・治療デバイスの開発に活用します(図2)。
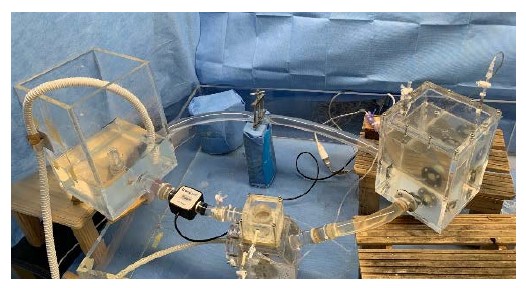
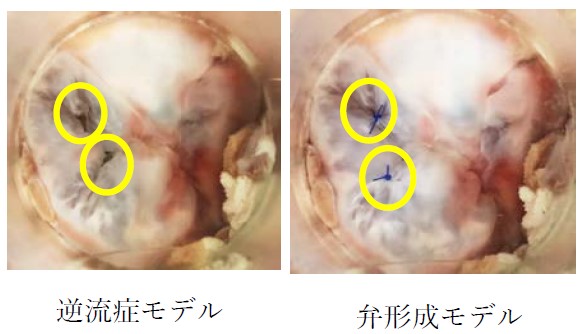
図1 僧帽弁閉鎖不全症を模した拍動循環試験システム 図2 弁モデル
三尖弁閉鎖不全症に対する治療法を評価する生体外評価試験システムの研究開発
三尖弁は右心室と右心房の間にある弁であり、この弁が閉鎖不全により逆流する状態を三尖弁閉鎖不全症と呼びます。三尖弁閉鎖不全症に対する高い治療効果を示す治療法は現在も開発されておらず、超高齢社会において患者QOL向上のための治療技術開発が求められています。治療対象となる重度三尖弁閉鎖不全症の多くは右心系の拡大に伴う弁接合不全により生じており、右心系拡大を考慮した弁疾患モデルの開発が重要となります。
本研究では弁輪組織を分解させながら拡張したブタ摘出右心室組織を高分子製右心室モデルに縫着することにより逆流症モデルを開発しました。開発した逆流症モデルを体循環模擬シミュレータ(図1)に取り付け、逆流症モデルに形成術を施行することにより形成前後(図2)における血行動態の違いを計測し新たな治療法・治療デバイスの開発に活用します。
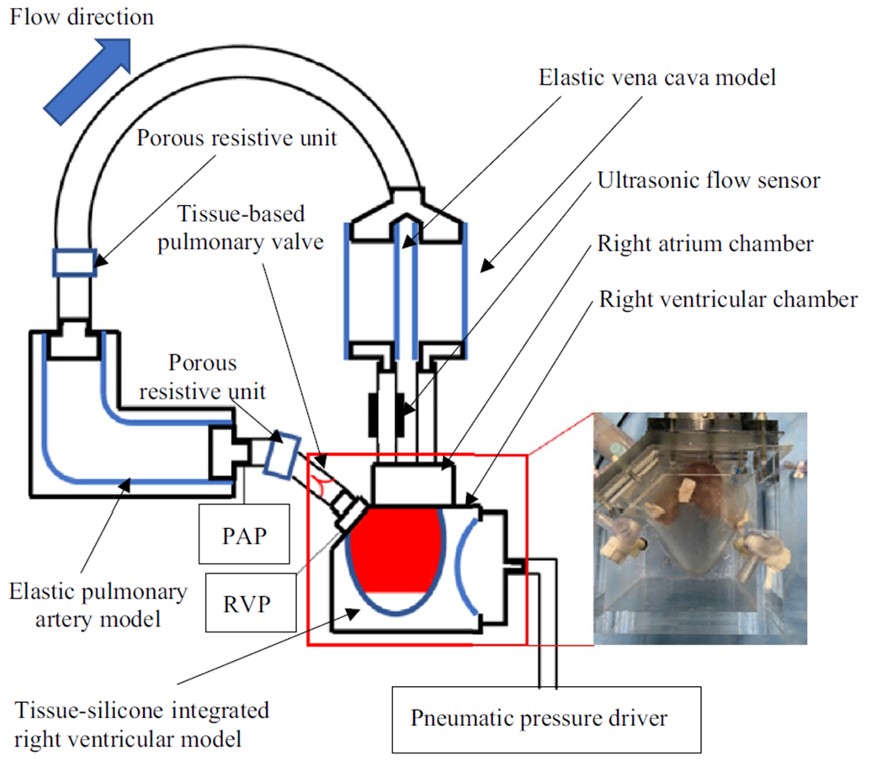
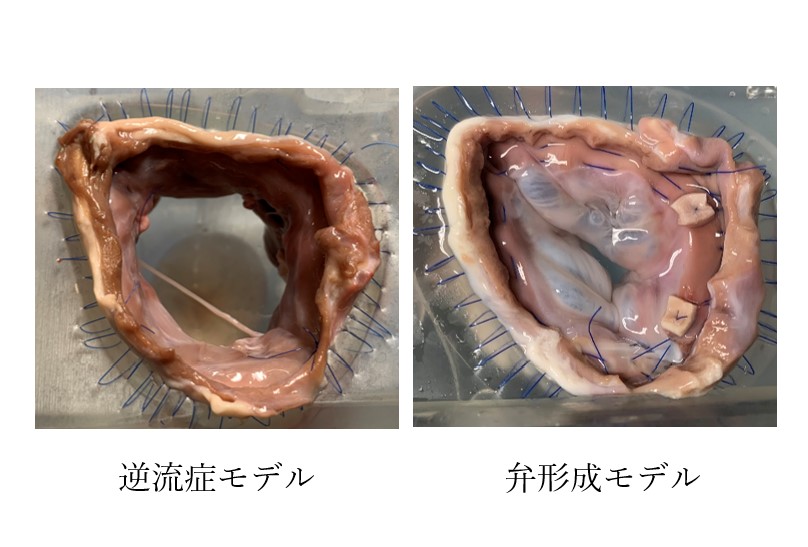
図1 体循環シミュレータ 図2 弁モデル
補助循環デバイス評価のための心原性ショック状態を模擬した拍動循環シミュレータの研究開発
心臓の機能が急激に低下する心原性ショックに対する低侵襲的治療法として補助循環デバイスであるECMOやIMPELLA といった補助循環デバイスが用いられています。これらは機能低下した心臓に代わって血液を全身に送り出すことで循環を補助し、自己心機能の回復を期待する機械的補助循環デバイスです。心原性ショックに対する補助循環デバイスの使用は血行動態に対して大きな有効性がある一方で、実臨床においては個々の状態変化が激しく、定量的な評価が困難です。また動物実験では心原性ショック状態の個体を用意することが困難です。そのため非生理的血行動態を模擬する生体外評価試験システムの開発が重要となります。
そこで本研究では心原性ショック状態を模擬した拍動循環シミュレータ(図1)を開発し,機械的補助循環デバイス性能評価試験を実施しています.本シミュレータはヒト生体内の流量圧力環境を模擬しています(図2)。機械的補助循環デバイスを使用した際にどのように血行動態が変化するかを計測することで、既存デバイスの課題点を克服することができる新規補助循環デバイスの開発に活用しております。
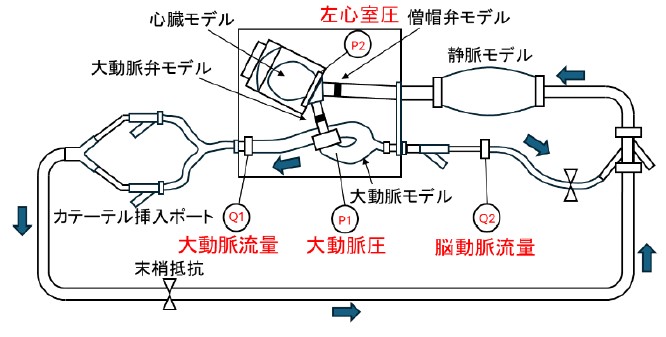
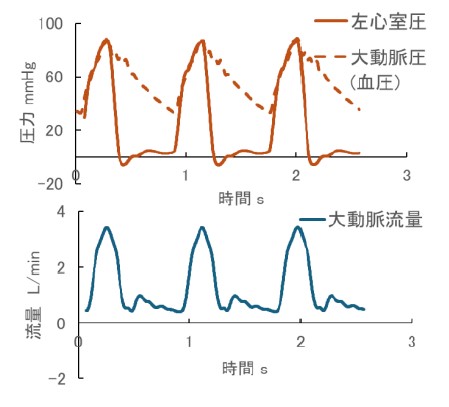
図1 作製した拍動循環シミュレータの概略図 図2 創出した圧流量波形
左心系と右心系の双方の血行動態を評価する両心拍動循環シミュレータの研究開発
ヒトの心臓は右心房、右心室、左心房、左心室の二心房二心室構造を持っています。静脈→右心房→右心室→肺動脈→肺静脈→左心房→左心室→大動脈の一方向に血液が流れる「直列循環」で、4つの心臓弁によって逆流が制御されてます。左心室と右心室の機能は互いに影響を受け合っており、左心室のポンプ機能が低下すると(左心不全)、肺血管の内圧が上昇し、右心室の機能に影響を及ぼします(右心不全)。そのため、心臓弁膜症などの心疾患、心不全、それらに対する外科的治療が血行動態に与える影響をより深く理解するためには、左心系と右心系の双方の血行動態を評価する生体外試験システムが必要となります。
本研究では、体循環(左心室→大動脈→静脈→右心房)および肺循環(右心室→肺動脈→肺静脈→左心房)の双方の血行動態を評価する両心拍動循環シミュレータの研究開発に取り組んでいます(図1)。このようなシミュレータを用いて、手術や人工心臓(LVAD)などの治療が、左心系および右心系の血行動態に与える影響を定量的に分析し(図2)、治療効果の評価や新規治療法の開発に活かすことを目指しています。
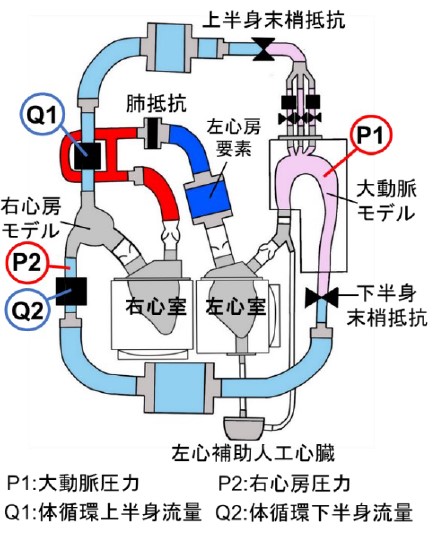
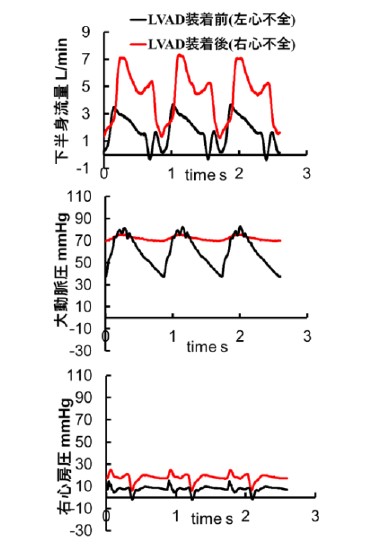
図1 両心拍動循環シミュレータ 図2 人工心臓駆動中の左心系・右心系の血行動態の変化
肺動脈絞扼術が拡張型心筋症患者に及ぼす血行動態改善効果の流体力学的評価
拡張型心筋症(DCM:Dilated Cardiomyopathy)は小児心不全の主な原因の一つであり、重症例は心臓移植の適応となります。深刻なドナー不足により、心不全の進行を抑え、症状を緩和するための代替治療法の開発が求められています。肺動脈絞扼術(PAB:Pulmonary Artery Banding)は先天性心疾患の治療法として広く用いられていますが、近年、左心室機能を回復させる可能性が示され、DCMの新たな治療法として注目されています。一方で、PABがDCM患者に与える血行動態の変化や左心室機能の改善メカニズムは、未だ十分に解明されていません。そのため、PABの治療効果を適切に予測し、適応範囲を明確にするには、流体力学的観点からこれらのメカニズムを解明する必要があります。
本研究では、DCM患者の血行動態を模擬し、PABが両心室にもたらす相互的な影響を「流れ」と「形態(心室中隔の動き)」の両面から評価可能な、両心室一体型拍動循環シミュレータの開発を進めています。さらに、数値シミュレーションを用いてPAB施行前後の心室内血流動態を分析し、これらの知見を融合することで、PABがDCM患者の左心室機能に及ぼす影響を流体力学的観点から解明することを目指します(図1)。
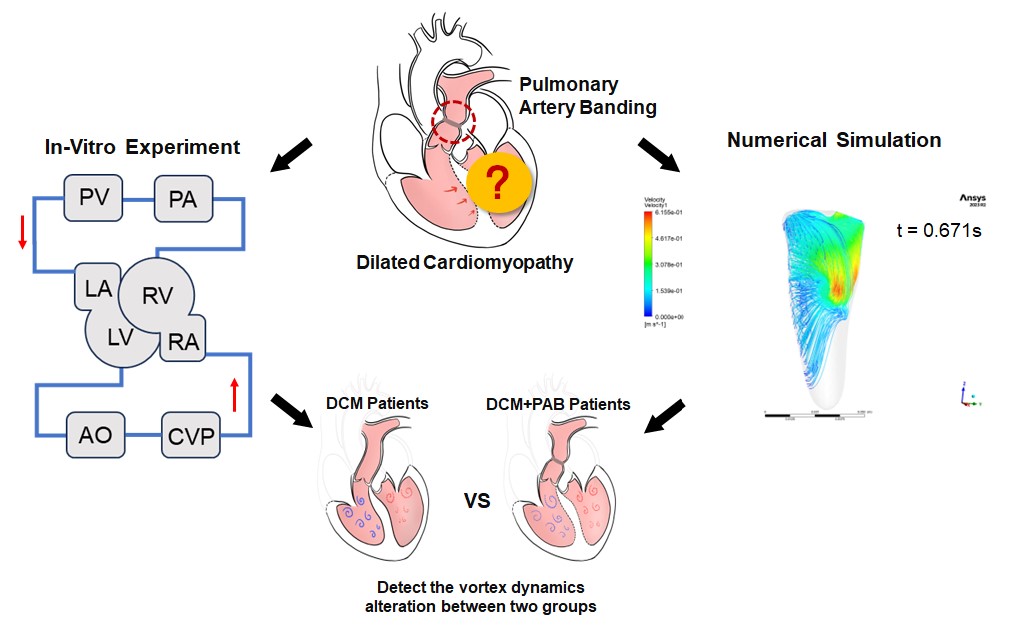 図1 研究内容の概要図
図1 研究内容の概要図


